هدف آزمایش : تهیه ی محلول با غلظت مشخص توسط نمونه ی جامد و مایع
مقدمه و تئوری :
محلول محلول ها، مخلوط های همگن اند. محلول ها را اغلب بر اساس حالت فیزیکی آنها طبقه بندی می کنند ؛ محلول های جامد، گازی، و مایع
حلال:معمولاً جزئی از یک محلول را که از لحاظ مقدار بیش از اجزای دیگر است را حلال می نامند. البته کاربرد این واژه اختیاری است و دقت چندانی ندارد. گاهی آسانتر است که جزئی از محلول را با آنکه مقدارش کم است حلال بنامیم. در توصیف محلول های گازی کاربرد واژه های حلال و حل شونده اهمیت چندانی ندارد.
حل شونده ؟معمولاً جزئی از یک محلول که از لحاظ مقدار کمتر از اجزای دیگر است را حل شونده می نامند.
غلظت ؟مقدار ماده ی حل شده در مقدار مشخصی حلال یا محلول را گویند.
محلول رقیق: محلولی که غلظت ماده ی حل شده در آن نسبتاً کم باشد.
محلول غلیظ: محلولی که غلظت ماده ی حل شده در آن نسبتاً زیاد باشد.
انحلال پذیری:بیشترین مقدار از یک ماده که در مقدار معینی حلال حل می شود و سیستم پایداری به وجود می آورد.
محلول سیر شده ( اشباع شده ) : محلولی که در آن سرعت حل شدن ماده ی حل شونده ی خالص برابر با سرعت خارج شدن ماده ی حل شده از محلول است. که در نتیجه غلظت ماده ی حل شده، در حال تعادل، ثابت می ماند.
محلول سیر نشده : در این محلول، غلظت ماده ی حل شده، کمتر از غلظت آن در یک محلول سیر شده است.
محلول فوق سیر ( فوق اشباع ) : فقط در صورتی که ماده ی حل شونده جامد باشد، میتوان محلولی تهیه کرد که غلظت ماده ی حل شده در آن بیشتر از غلظت یک محلول سیر شده است. این نوع محلول ها نیم پایدارند و اگر مقدار بسیار کمی از حل شونده به آن افزوده شود، مقدار اضافی رسوب می کند.
?غلظت یک ماده ی حل شده در یک محلول را به شیوه های گوناگون می توان بیان کرد.
انواع غلظت :
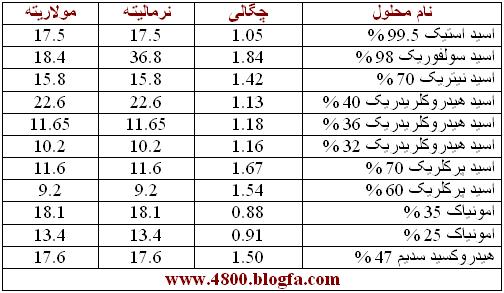
- مولاریته (M)تعداد مول های ماده ی حل شده در یک لیتر از محلول.
مولاریته یکی از پرکاربرد ترین مفاهیم غلظت در شیمی تجزیه می باشد.
این تعریف بر اساس حجم کل محلول استوار است. وقتی غلظت محلول بر حسب مولاریته بیان میشود، محاسبه مقدار ماده حل شده موجود در یک نمونه معین از محلول آسان است. تعداد مولهای جسم حل شده از تقسیم کردن وزن آن بر حسب gr به وزن فرمولی آن (وزن مولکولی ، وزن اتمی ، وزن یونی) بدست میآید.
- درصد وزنی – حجمی (%W/V)
این غلظت برای بیان ترکیب محلولهای آبی رقیق و واکنشگرهای جامد به کار می رود بنابراین یک محلول آبی 5% از نیترات نقره محلولی می باشد که ازحل کردن 5 گرم نیترات نقره درمقدارکافی آب مقطر برای تولید 100 میلی لیتر محلول استفاده شده است.
وزن ماده ی حل شده به گرم
100× ــــــــــــــــــــــــــــــ ــــــــــــ = W/V %
حجم محلول به میلی لیتر
- نرمالیته (N)
تعداد هم ارز گرم های ( اکی والان های ) ماده ی حل شده در یک لیتر محلول.
نرمالیته ی یک محلول مانند مولاریته با تغییر دما اندکی تغییر میکند.
- گرم بر لیتر (C)عبارت است از مقدارگرمهای جسم حل شده دریک لیترمحلول.
گرم جسم حل شدهـــــــــــــــــــــ = Cلیترمحلول
- مولالیته (m)تعداد مول های ماده ی حل شونده در یک کیلوگرم حلال
تعداد مول های ماده ی حل شوندهـــــــــــــــــــــــــ ــــــــــــــــ = مولالیته ( m) وزن حلال بر حسب کیلوگرم
مولالیته یک محلول عبارت است از عدد مولهای حل شده در 1000 گرم حلال. مولالیته یک محلول آبی بسیار رقیق همان مولاریته آن محلول است زیرا 1000 گرم آب تقریبا 1000 گرم حجم اشغال می کند.
-کسر مولی ( X)
کسر مولی یک جزء از محلول برابر با نسبت عدّه ی مول های آن جزء بر کل مول های تمام موارد موجود در محلول است.
که در آن کسر مولی A و ,... عده ی مول های C , B , A و ... است. مجموع کسر مولی تمام اجزای موجود در محلول باید 1 باشد.
-درصد وزنی (%W)درصد وزنی یک ماده حل شده دریک محلول عبارتست از:
100× ــــــــــــــــــــــــــــــ ــــــــــــــــــــــــــــــ ــــ%W =
گرم های حلال + گرم های جسم حل شده
بشر 100-ml - هم زن شیشه ای - ظرف توزین – پیپت – دو عدد بالن ژوژه 250-ml – ترازو با دقت 1/0 گرم
مواد : محلول HCl غلیظ ، NaOH جامد
1- بالن حجم سنجی را با آب و مایع ظرف شویی شسته و با آب مقطر آبکشی می کنیم.
2- ظرف توزین را شسته و با آب مقطر آبکشی کرده و برای خشــک کردن آن را در دمای 100 در جه ی سانتیگراد ، به مدت یک ساعت درون اتوکلاو قرار می دهیم.
سپس 30 تا 45 دقیقه آن را درون دسیکاتور می گذاریم تا سرد شود و به دمای اتاق برسد.
3- مقداری از نمونه ی جامد را که برای تهیه محلول با غلظت معین محاسبه کرده ایم را به دقت وزن کرده؛
و سپس با مقدار کمی آب مقطر به داخل بالن ژوژه انتقال می دهیم.
4- درِ بالن ژوژه را می بندیم و آن را تکان می دهیم تا نمونه به طور کامل حل شود. بعد آن را با آب مقطر به حجم می رسانیم ( باید خط نشانه ی ظرف، مماس بر گودترین نقطه ی سطح هلالی محلول باشد ) مجدداً درِ بالن را بسته و آن را تکان می دهیم تا محلول به
5- اگر ماده ی اولیه ی محلول مورد نظر مایع است، حجم آن را از روی مشخصات شیشه محاسبه می کنیم و با یک پیپت دقیق، مقدار لازم را در بالن ژوژه میریزیم و آن را به حجم می رسانیم.
» بحث و نتیجه گیری«
محاسبات مربوط به این آزمایش :
در آزمایش محلول سازی توسط نمونه ی جامد (NaOH )
هدف ساختن 100ml محلول سود 0.1 M از سود 98% بود :
در آزمایش محلول سازی توسط نمونه ی مایع ( HCl )
هدف ساختن 100ml محلول HCl ، 0.5 M از اسید غلیظ 37% با چگالی 1/19 است.
نتیجه : درپایان بحث، بهترین نتیجه ای که می شود از این آزمایش گرفت این است که ما میتوانیم از یک نمونه ی مایع یا جامد، با کمک گرفتن از روابط شیمیایی و همچنین کار در محیط آزمایشگاه، محلولی با غلظت مشخص بسازیم.
- چرا تعیین غلظت محلولها بر مبنای حجم آنها روش مطلوبی نیست؟
زیرا وقتی دما تغییر کند، محلول منبسط یا منقبض می شود و به این ترتیب غلظت بر مبنای حجم تغییر می کند.
راه حل : باید محلولی تهیه شود که مولاریته ی آن، در دمای استفاده از محلول تعیین شده باشد.


 تهيه معرف يونيورسال بوگن
تهيه معرف يونيورسال بوگن




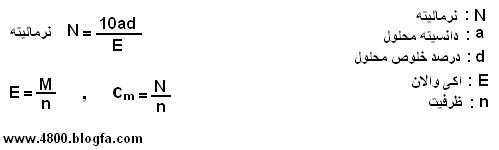
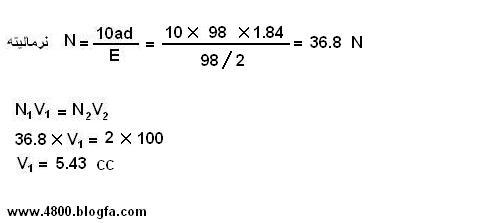
 حالت خطی
حالت خطی

