| فنی و مهندسی در این زیر تالار به بحث و گفتگو در مورد رشته های فنی و مهندسی پرداخته میشود |

02-26-2010
|
 |
|
|
تاریخ عضویت: Aug 2009
نوشته ها: 16,247
سپاسها: : 9,677
9,666 سپاس در 4,139 نوشته ایشان در یکماه اخیر
|
|
 لانتانیدها
لانتانیدها
لانتانیدها
لانتانیدها عنصرهای 58 تا 71جدول تناوبی را تشکیل میدهند و جزو عناصر واسطه داخلی میباشند. وجه تسمیه لانتانیدها از عنصر 57 جدول یعنی لانتان (La) گرفته شده است. باید توجه داشت که خواص شیمیایی این دسته از عناصر مشابه خواص لانتان میباشد همچنین به این گروه از عناصر ، عناصر خاکهای کمیاب "Rare-earth elements"نیز اطلاق میشود. در واقع اطلاق نام خاکهای نادر یا کمیاب ، از آنجائیکه این عناصر نه کمیابند و نه به آن دسته از اکسیدهای خاکی مانند (اکسیدهای) آلومینا، زیرکونیا و ایتریا تعلق دارند، غلط مصطلح است. زمانیکه نخستین اعضای این گروه برای اولین بار کشف شد، بصورت اکسید مجتمع گردیده بودند و از آنجائیکه این اکسیدها تا اندازهای به اکسیدهای کلسیم ، منیزیم و آلومینیوم که بعدها به آنها عنوان اکسیدهای خاکی اطلاق گردید، شباهت دارند، لذا این عناصر به نام خاکهای کمیاب معروف گردیدند. در هر صورت باید توجه داشت که سریم در پوسته زمین بسیار فراوان تر از سرب بوده و نیز ایتریم از قلع بسیار فراوانتر است و حتی باید اذعان نمود که کمیاب ترین خاکهای کمیاب ، به استثنای پرومتیم ، بسیار از عناصر گروه پلاتین فراوانترند.
منابع طبیعی
اگرچه لانتانیدها بصورت بسیار گسترده در طبیعت پخش میباشند، لکن بطور کلی در غلظتهای کم یافت میشوند. همچنین در برخی از مواد کانی بصورت مخلوط و در غلظتهای زیاد ملاحظه شده اند. جدول زیر نمایانگر برخی از کانیهای معروف لانتانیدها میباشد.
ماده کانی شکل بلور ترکیب فرمولی
مونازیت (monazite) تک شیب CePO4 با Th3(PO4)4
زنوتیم (xenotime) چهارگوش YPO4
گادولینیت (gadolinite) تک شیب 2BeO.FeO.Y2O3.2SiO2
بستناسیت (bastnasite) ششگوش CeFCO3
سامارسکیت (samarskite) مکعب مستطیل Ca٫Fe٫UO2)3O.Y2O3.3(Nb٫Ta)2O5)
فرگوزونیت (fergusonite) چهارگوش Y2O3.3(Nb٫Ta)2O5
اوکسنیت (euxenite) مکعب مستطیل Y2(NbO3)3.Y2(TiO3)3.1½H2O
ایتروفلوئوریت (yttrofluorite) مکعب 2YF3.3CaF3
مهمترین کانیهای خاکهای کمیاب عبارتند از:مونازیت ، زنوتیم ، بستناسیت. معمولا این مواد بوسیله اعمال مکانیکی مانند شناورسازی و یا استفاده از روشهای مغناطیسی تغلیظ میشوند. سپس لانتانیدها در حالتیکه بصورت کانیهای فسفات یا سیلیکات میباشند، بوسیله اسید مورد شستشو قرار میگیرند. برخی از کانیها مانند کولومبوتانتالاتها با کربن حرارت داده شده و یا تحت تاثیر کاستیک قوی قبل از سنگ شویی قرار داده میشوند.
تجزیه و جداسازی
لانتانیدهای مخلوط شده را میتوان از محلولهای اسیدی با استفاده از رسوب اگزالات جدا کرد. اشتعال اگزالات باعث تولید اکسیدهای لانتانیدهای مخلوط خواهد گردید. سپس این اکسیدها غالبا با استفاده از روشهای تبادل یونی و استفاده از خیساندن در اسید تغلیظ میشوند. در این حال لانتانیدها در محلول بصورت یونهای سه ظرفیتی هیدراته که دارای خواص بسیار مشابه میباشند، درمیآیند. بنابراین آنها تمایل به تشکیل رسوبهای بلوری مخلوط یا محلولهای جامد نشان میدهند. استفاده از یک ماده شیمیایی واحد به منظور افزایش غلظت یکی از عناصر خاکهای کمیاب لزوم تکرار عملیات را ایجاب مینماید. یکی از روشهایی که در گذشته و حال مورد استفاده بوده و هست، استفاده از فرایندهای جزء به جزء مانند تبلور جزء به جزء و یا تجزیه جزء به جزء به منظور خالص کردن عناصر می باشد. در این شرایط ، مقدار کار بسیار زیاد به منظور جداکردن مقدار بسیار کمی از عناصر ، باعث بالارفتن هزینه های خلوص خاکهای کمیاب و برشمردن آنها بدین صنعت خواهد بود. اکنون نیز از روشهای جزء به جزء هنوز در زمینه جداسازی این خاکها در حالت خام و بویژه عناصر لانتان و سریم استفاده میشود، زیرا سریم را می توان از لانتان با استفاده از حالت چهار ظرفیتی سریم جدا کرد. در حال حاضر سایر اعضای خانواده خاکهای کمیاب را با استفاده از فرآیندهایی تبادل یونی خالص می نمایند مضافا چنانچه درجه خلوص بالا مدنظر نباشد، می توان از روش استخراج مایع- مایع بدین منظور استفاده کرد.
خواص لانتانیدها
لانتانیدها فلزهایی براق هستند و واکنش پذیری شیمیایی قابل توجهی دارند. خواص شیمیایی این دسته از عناصر مشابه خواص لانتان با عدد اتمی 57 می باشد. کلیه این عناصر قادر به تشکیل املاح سه ظرفیتی می باشند و زمانیکه این املاح در آب حل می شوند، خواص شیمیایی بسیار مشابه از خود نشان می دهند. لانتانیدها ، نظر به وضعیت جدو!ل تناوبی، بدین صورت هستند که همچنانکه عدد اتمی آنها افزوده می شود، بار افزوده شده روی هسته آنها بوسیله پر شدن لایه های ناقص داخلی آنها با الکترونها ، موازنه میشود. ولی به هر حال باید توجه داشت که این لایه ها نقشی در نیروهای والانس ما بین اتمها ایفا نمی نمایند. لانتانیدها به علت برخوردار بودن از خواص اختصاصی دارای پتانسیل باارزشی در زمینه استفاده بعنوان عوامل آلیاژی میباشند. این عناصر با استفاده از احیاء گرمایی بوسیله اثر کلسیم ، لیتیم و یا سایر فلزات قلیایی برهالید بی آب آنها و سپس ذوب مجدد در خلا به منظور تبخیر نشانه های باقیمانده از مواد احیا کننده، احیا می شوند. همچنین میتوان آنها را بصورت الکترولیتی از حمامهای ملح ذوب شده مانند آنچه در زمینه سریم و میش متال (مخلوط فلزات خاکهای کمیاب ، اساسا سریع با مقدار بسیار کمی از آهن) صورت می پذیرد، احیا کرد. باید توجه داشت که مواد جامد بدون آب همچنین نشان دهنده تغییر زیادتری در خواص ما بین عناصر نسبت به املاح هیدراته هستند. خاکهای کمیاب با بعضی از ترکیبات آلی ، املاح آلی تشکیل میدهد. این کیلیت ها که در اطراف این یونها ، آب جایگزین می نمایند، باعث زیاد شدن تغییر در خواص ما بین هر یک از خاکهای کمیاب میشوند. سودمندی این تکنیک در روشهای جدید تبادل یونی ، در زمینه جداسازی این عناصر کاملا قابل ملاحظه است.
موارد کاربرد
فلزات خاکهای کمیاب تمایل بسیار شدید برای ترکیب با ناخالصیهای غیر فلزی مانند اکسیژن ، نیتروژن ، کربن و هیدروژن دارند. لذا با توجه به خاصیت فوق ، مقدار قابل ملاحظه ای از مخلوط فلزات خاکهای کمیاب بعنوان مواد تصفیه کننده (getler) در صنایع متالوژی مورد استفاده واقع می شود.
عناصر خاکهای کمیاب ، هنگامیکه تحت تاثیر حرارت واقع می گردند نمایانگر طیف بسیار پیچیده ای بوده و نور شدید سفید زدگی از آنها ساطع می شود، بنابراین از آنها در صنایع تصاویر متحرک و لامپ های تصویر تلویزیون های رنگی استفاده می گردد.
مصارف صنعتی فراوانی نیز برای هر یک از این عناصر متصور می باشد از جمله از برخی از آنها در سوزاندن سموم ناشی از راکتورهای هسته ای استفاده می شود.
__________________
زمستان نیز رفت اما بهارانی نمی بینم
بر این تکرارِ در تکرار پایانی نمی بینم
به دنبال خودم چون گردبادی خسته می گردم
ولی از خویش جز گَردی به دامانی نمی بینم
چه بر ما رفته است ای عمر؟ ای یاقوت بی قیمت!
که غیر از مرگ، گردن بند ارزانی نمی بینم
زمین از دلبران خالی است یا من چشم ودل سیرم؟
که می گردم ولی زلف پریشانی نمی بینم
خدایا عشق درمانی به غیر از مرگ می خواهد
که من می میرم از این درد و درمانی نمی بینم
استاد فاضل نظری |
|
جای تبلیغات شما اینجا خالیست با ما تماس بگیرید
|
|

02-26-2010
|
 |
|
|
تاریخ عضویت: Aug 2009
نوشته ها: 16,247
سپاسها: : 9,677
9,666 سپاس در 4,139 نوشته ایشان در یکماه اخیر
|
|
 متبلور کنندهها
متبلور کنندهها
متبلور کنندهها
تبلور ، تشکیل ذرات جامد منظم در یک فاز همگن مایع میباشد. تبلور از آن نظر که مواد مختلفی بلوری در بازار عرضه میشود، اهمیت زیادی دارد. بلوری که در محلولی ناخالص تشکیل میشود، خود خالص است (مگر اینکه بلورهای بهصورت مخلوط ظاهر شوند) و تبلور روش عملی برای بدست آوردن مواد شیمیایی خالص در شرایط مطلوب برای بستهبندی و نگهداری است. روشن است که هدف تبلور ، تهیه محصول خوب با خلوص بالاست، اما ظاهر و حدود اندازه بلور نیز مهم میباشد.
ماگما
در تبلور صنعتی ، مخلوط متشکل از دو فاز محلول مادر و بلورهای با اندازه مختلف را که متبلور کننده را اشغال کرده است و بهصورت محصول از دستگاه خارج میشود، ماگما گویند.
هندسه بلور
بلور در واقع ، سازمان یافته ترین نوع مواد بیجان است. از خصوصیات مهم بلور ، این است که ذرات سازنده آن که اتم ، مولکول و یا یون هستند ، در آرایشهای منظم سهبعدی به نام شبکه فضایی کنار هم چیده شدهاند. اگر بلور ، بدون هیچگونه مانعی ناشی از طرف بلورهای دیگر یا اجسام خارجی تشکیل شود، انها بهصورت چهار وجهی هایی با گوشههای تیز و پهلوها یا وجوه تخت ظاهر میشوند. این زوایا و وجوه برای همه بلورهای یک ماده کاملا مساوی میباشد.
چون همه بلورهای یک ماده معین ، زوایای بین وجوه یکسان دارند، علیرغم تفاوتهایی که در میزان رشد هر یک از وجوه وجود دارد، اشکال بلورها را بر اساس این زوایا رده بندی میکنند. در شرایط ایدهآل ، بلور در حال رشد تشابه هندسی خود را حفظ میکند که به آن ، بلور تغییر ناپذیر میگویند.
بلور سالم و خوب ، تقریبا خالص است، ولی وقتی از ماگمای نهایی خارج میشود. مقداری از محلول مادر را در خود نگه میدارد و اگر محصول ، حاوی بلورهای بهم چسبیده باشد، مقادیر محلول مادر بیشتر میباشد. وقتی که محلول مادر نگه داشته شده که خلوص کمتری دارد ، خشک میشود، آلودگی در بلور بوجود میآید. میزان این آلودگی بستگی به مقدار و درجه ناخالصی محلول مادر دارد. با توجه به اینکه در عمل مقدار بیشتری از محلول مادر نگه داشته میشود، لازم است با تصفیه یا گریز از مرکز از بلورهای حاصل جدا گردد و باقیمانده ، از طریق شستشو با حلال تازه جداسازی شود.
تعادل و میزان محصول
تعادل در فرآیندهای تبلور وقتی حاصل میشود که محلول اشباع شود و رابطه تعادل برای بلورهای انبوه ، منحنی قابلیت انحلال بلورهای کوچکتر از بلورهای بزرگ میباشد.
دستگاه تبلور
ظروف تبلور تجارتی ممکن است بهصورت پیوسته یا ناپیوسته کار کنند. عموما عملیات پیوسته ترجیح داده میشود. اولین شرط در هر ظرف تبلور ایجاد محلول فوق اشباع است، چون تبلور بدون فوق اشباع صورت نمیگیرد. همان طوریکه قبلا نیز اشاره گردید، سه روش برای ایجاد محلول فوق اشباع بکار میرود که عبارتند از سرد کردن ، تبخیر حلال و یا تلفیقی از این دو و یا روشهای دیگر. ظروف تبلور از جنبههای مختلف ممکن است با هم متفاوت باشند. تفاوت عمده آنها در نحوه تماس بلورها با مایع فوق اشباع میباشد. دو روش کلی برای این تماس وجود دارد:
در روش اول ، که روش مایع در حال گردش نام دارد، جریانی از محلول فوق اشباع از بستر سیال شده بلورهای در حال رشد عبور میکند که فوق اشباع با هستهزایی و رشد ، آزاد میشود. آنگاه مایع اشباع شده را از طریق ناحیه سرد کننده یا تبخیر پمپ میکنند که در آن ، فوق اشباع تولید میشود و در نهایت محلول فوق اشباع از طریق ناحیه متبلور باز گردانده میشود.
در روش دوم که روش ماگمای در حال گردش نامیده میشود، کل ماگما در مراحل تبلور و فوق اشباع گردش داده میشود. بدون اینکه مایع را از جامد تفکیک کنند، فوق اشباع و تبلور در حضور بلورها صورت میگیرد.
در هر دو روش ، محلول خوراک به جریان بین نواحی متبلور و فوق اشباع کننده اضافه میشود.
انواع ظروف تبلور
در نوعی از ظروف تبلور ، از وسایلی که مواد را بر حسب اندازه ردهبندی میکنند، استفاده میشود این ظروف تبلور در حالت ایدهآل ، محصولی با اندازه یکنواخت تولید میکنند.
ظروف تبلور دیگر برای نگهداری سوسپانسیونی که در ناحیه تبلور بهخوبی مخلوط میشود، طراحی شده است که بلورهای به اندازههای مختلف از هسته تا بلورهای درشت ، بصورت یکنواخت در سراسر ماگما توزیع میشود.
بعضی از ظروف تبلور ، دو خط مجزا دارند که یکی برای ذرات ریز و دیگری برای ذرات درشت میباشد. بعد این دو خط با هم ترکیب شده به یک صافی یا واحد جداسازی دیگر ، فرستاده میشود.
در اکثر ظروف تبلور از نوعی همزن برای افزایش سرعت حرکت استفاده میگردد تا از تفکیک محلول فوق اشباع و هستهزایی بیشتر جلوگیری کند و بلورها را در منطقه تبلور بهصورت معلق نگه دارد. برای این کار ، از همزنهای پروانهای داخلی استفاده میگردد. پمپهای بیرونی نیز برای گردش ماگما در نواحی فوق اشباع یا تبلور بکار گرفته میشود. روش اخیر را گردش اجباری گویند.
ظورف تبلور در خلا: اکثر ظروف تبلور جدید در رده واحدهای خلاء جای میگیرند که در آنها از سرمایش تبخیری آدیاباتیک برای ایجاد فوق اشباع استفاده میشود. شکل اولیه و ساده این ظروف تبلور بهصورت ظرف در بسته ای است که در آنها ، خلاء بوسیله یک مبرد و به کمک پمپ خلاء یا افشانه بخار آب ، یا تقویت کننده ای که بین ظرف تبلور و مبرد واقع شده است، ایجاد میشود. حجم ماگما با کنترل سطح مایع و جامد متبلور شده ، در سطح معینی ثابت نگه داشته میشود.
__________________
زمستان نیز رفت اما بهارانی نمی بینم
بر این تکرارِ در تکرار پایانی نمی بینم
به دنبال خودم چون گردبادی خسته می گردم
ولی از خویش جز گَردی به دامانی نمی بینم
چه بر ما رفته است ای عمر؟ ای یاقوت بی قیمت!
که غیر از مرگ، گردن بند ارزانی نمی بینم
زمین از دلبران خالی است یا من چشم ودل سیرم؟
که می گردم ولی زلف پریشانی نمی بینم
خدایا عشق درمانی به غیر از مرگ می خواهد
که من می میرم از این درد و درمانی نمی بینم
استاد فاضل نظری |

02-26-2010
|
 |
|
|
تاریخ عضویت: Aug 2009
نوشته ها: 16,247
سپاسها: : 9,677
9,666 سپاس در 4,139 نوشته ایشان در یکماه اخیر
|
|
 کمپلکس ها
کمپلکس ها
کمپلکس ها
دید کلی
در شیمی معدنی ترکیباتی وجود دارند که در آن اتم مرکزی حداقل با یک پیوند داتیو با گروه اتمهای اطراف خود (لیگندها) ارتباط برقرار میکند. در این ترکیبات اتم مرکزی گیرنده جفت الکترون میباشد، چنین ترکیباتی را کمپلکس یا ترکیبات کئوردیناسیونی مینامند. اتم مرکزی در این ترکیبات معمولاً دارای یک حفره الکترونی میباشد که میتواند الکترونهای جفت نشده لیگند را بگیرد و یک پیوند کووالانسی-کئوردیناسیونی ، (داتیو) تشکیل دهد.
کمپلکسهایی که در آنها انتقال الکترون میتواند در تشکیل پیوند نقش بسزایی داشته باشد کمپلکسهای دهنده - گیرنده مینامند. اکثر عناصر جدول تناوبی اعم از فلزات گروه اصلی ، فلزات گروه واسطه و غیر فلزات میتوانند کمپلکس تشکیل دهند.
تاریخچه
تا سال 1913 ساختمان کمپلکسها مشخص نشده بود اما در این سال آلفرد ورنر پدر شیمی کوئوردیناسیونی نظر خود را در مورد ساختمان کمپلکسها اعلام کرد و این در حالی بود که هنوز ساختمان الکترونی اتم مشخص نشده بود. قبل از ورنر دانشمندی به نام یورگنسون برای برخی از کمپلکسها ساختارهایی تعیین کرده بود که با اعلام نظریه ورنر اشتباه بودن این ساختارها مشخص شد.
ورنر به دلیل مطالعاتی که روی کمپلکسهای هشت وجهی ، مسطح مربعی و چهار وجهی انجام داد و بنیانگذار شیمی کوئوردیناسیون شد، جایزه نوبل شیمی را در سال 1913 دریافت کرد.
نظریه ورنر
هر اتم دارای دو ظرفیت میباشد. ظرفیت اصلی و ظرفیت والانس فرعی ، بنابراین لزومی ندارد که فقط به اندازه ظرفیت اصلی یک اتم ، اتمهای دیگر به آن وصل شود بلکه بعد از پر شدن ظرفیت اصلی که فضای کئوردیناسیونی داخلی را تشکیل میدهد. اتمها میتوانند به ظرفیت فرعی یا فضای کئوردیناسیون خارجی که نشانگر عدد اکسیداسیون اتم مرکزی است، وارد شوند.
تا قبل از اینکه ورنر این نظریه را اعلام کند دانشمندان در تعیین ساختمان ترکیباتی مانند اختلاف نظر داشتند. این ترکیب یک ترکیب یونی است و کلرها در آب به راحتی یونیزه میشود. اما ها به آسانی جدا نمیشوند مگر اینکه ترکیب در اسید قوی جوشانده شود. یورگنسون اولین ساختمان را بر این ترکیب به صورت زیر پیشنهاد کرد.
عکس پیدا نشد
اما ورنر این ترکیب را یک یک ساختمان هشت وجهی پیشنهاد کرد که اتم کبالت در مرکز و ها با شش پیوند هم اندازه در اطراف و یونهای کلر هم در فضای کئوردیناسیون خارجی حضور داشتند.
لیگند
دستهای از اتمها که باهم هستند و یکی از اتمها میتواند جفت الکترونش را در اختیار اتم دیگر قرار دهد. لیگند ممکن است یک ترکیب خنثی یا یک آنیون باشد.
انواع کمپلکس
کمپلکسهای ورنر یا کلاسیک:ترکیبات کوئوردیناسیونی که در آنها فلز مرکزی با حالت اکسایش +2 یا بالاتر توسط اتمهای غیرکربن کئوردینه شدهاند کمپلکسهای ورنر یا کلاسیک نامیده میشوند (این نامگذاری به خاطر مطالعات ورنر در شیمی کئوردیناسیون انجام شده است.).
کمپلکسهای آلی فلزی :در این کمپلکسها فلز مستقیماً با کربن پیوند تشکیل میدهد. در این ترکیبات فلز در حالت اکسایش پایین خود مانند 2- و 1- و 0 و 1+ میباشد.
کمپلکسهای کلاستر یا خوشهای :در این ترکیبات اتم مرکزی گروهی از فلزات میباشند که باهم پیوند تشکیل دادهاند. مانند که اتمهای آهن در گوشههای یک مثلث جای گرفتهاند و گروههای کربونیل در اطراف آنها پیوند تشکیل میدهند.
عدد کوئوردیناسیون
تعداد اتمهایی که اتم مرکزی را در اولین قشر کئوردیناسیون ، کئوردینه کردهاند عدد کئوردیناسیون میگویند. عدد کئوردیناسیون هر ترکیب مشخص کننده ساختمان آن ترکیب میباشد. رایجترین عدد کئوردیناسیون در کمپلکسها عدد 6 و بعد از آن 4 میباشد.
عوامل مؤثر درتشکیل کمپلکس
لیگند مهمترین عامل در تشکیل کمپلکس میباشد. نوع لیگند ، اندازه لیگند و تعداد لیگند در پایداری کمپلکسها تأثیر فراوان دارد.
عامل دوم در تشکیل کمپلکس نوع فلز مرکزی میباشد.
انواع لیگند
1.لیگندهای یک دندانه:فقط دارای یک اتم کئوردینه کننده است. هالیدها ، نیترات ، انواع آمینها ، سولفات و از مهمترین لیگندهای یک دندانه هستند.
2.لیگندهای چند دندانه:این لیگندها دارای یک یا چند اتم کئوردینه کننده هستند. این لیگندها کمپلکسهای پایدارتری ایجاد میکنند و به کی سیلت یا شلاته کنندهها معروفند. یک کمپلکس میتواند به صورت آنیونی ، کاتیونی یا خنثی باشد.
__________________
زمستان نیز رفت اما بهارانی نمی بینم
بر این تکرارِ در تکرار پایانی نمی بینم
به دنبال خودم چون گردبادی خسته می گردم
ولی از خویش جز گَردی به دامانی نمی بینم
چه بر ما رفته است ای عمر؟ ای یاقوت بی قیمت!
که غیر از مرگ، گردن بند ارزانی نمی بینم
زمین از دلبران خالی است یا من چشم ودل سیرم؟
که می گردم ولی زلف پریشانی نمی بینم
خدایا عشق درمانی به غیر از مرگ می خواهد
که من می میرم از این درد و درمانی نمی بینم
استاد فاضل نظری |

02-26-2010
|
 |
|
|
تاریخ عضویت: Aug 2009
نوشته ها: 16,247
سپاسها: : 9,677
9,666 سپاس در 4,139 نوشته ایشان در یکماه اخیر
|
|
 ایزوتوپ
ایزوتوپ
ایزوتوپ
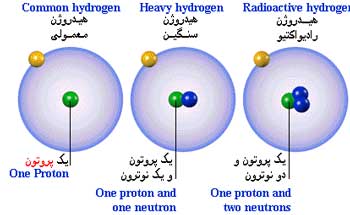
یکی از فرض های بدیهی نظریه اتمی دالتون این است که هر یک از اتمهای یک عنصر از هر لحاظ (از جمله جرم) با اتمهای دیگر آن یکسان است. ولی در اوایل قرن بیستم معلوم شد که یک عنصر ممکن است شامل چند نوع اتم باشد که اختلاف آنها با یکدیگر در جرم اتمی است. فردریک سودی اصطلاح ایزوتوپ (از واژه یونانی به معنای هم مکان) را برای اتمهای یک عنصر که که از نظر جرم با یکدیگر تفاوت دارند پیشنهاد کرد.
برای بررسی ایزوتوپها از طیف نگار جرمی استفاده می شود.دستگاههایی از این نوع ابتدا توسط فرانسیس استون (1919) و آرتور دمپستر (1918) با پیروی از اصول روشهایی که جی جی تامسون در 1912 ارائه کرده بود ساخته شد. اگر عنصری شامل چند نوع اتم با جرمهای متفاوت (ایزوتوپها ) باشد، این تفاوت در مقادیر یونهای مثبت حاصل از این اتمها پدیدار می گردد.طیف نگار جرمی یونها را بر حسب مقادیر نسبت بار به جرم ، از یکدیگر جدا می کند، و سبب می شود که یونهای مثبت متفاوت در محلهای مختلف روی یک صفحه عکاسی اثر کند.
وقتی دستگاه کار می کند، اتمهای بخار ماده مورد مطالعه در معرض بمباران الکترونی قرار گرفته و به یونهای مثبت تبدیل می شوند.این یونها بر اثر عبور از یک میدان الکتریکی ، به قدرت چندین هزار ولت ، شتاب پیدا می کنند. اگر ولتاژ این میدان ثابت نگه داشته شود، تمام یونهایی که مقدار بار به جرم مساوی دارند، با سرعت مساوی وارد یک میدان مغناطیسی می شوند. این سرعت، مقدار بار به جرم و شدت میدا مغناطیسی، شعاع مسیر یون را در میدان مغناطیسی تعیین می کند.
اگر شدت میدان مغناطیسی و ولتاژ شتاب دهنده ثابت نگه داشته شوند، تمام یونهایی که مقدار بار به جرم مساوی دارند، در یک محل بر روی صفحه عکاسی متمرکز می شوند. این محل را می توان با تغییر پتانسیلی که موجب شتاب یونها می شود، تغییر داد. ولی یونهایی که مقدار بار به جرم متفاوت دارند در محلهای مختلف روی صفحه عکاسی متمرکز می شوند. هر گاه یک وسیله الکتریکی که شدت اشعه یونی را اندازه می گیرد، جای گزین صفحه عکاسی شود، دستگاه را طیف سنج جرمی می نامیم. با استفاده از طیف سنج جرمی می توان هم جرم اتمی دقیق ایزوتوپها و هم ترکیب ایزوتوپی عناصر (انواع ایزوتوپهای موجود و مقدار نسبی هر یک) را تعیین کرد.
ایزوتوپها، اتمهایی با عدد اتمی مساوی و عدد جرمی متفاوتند. این اتمها دارای خواص شیمیایی بسیار مشابه هم (در اغلب موارد غیر قابل تشخیص) هستند. مثلا در طبیعت دو نوع اتم کلر وجود داردکه هر دو 17 پروتون و 17 الکترون دارند ولی یکی دارای 18 نوترون و دیگری دارای 20 نوترون است. بنابراین، اختلاف ایزوتوپها در تعداد نوترونهای هسته ها آنهاست. بعضی از عناصر فقط به یک شکل ایزوتوپی در طبیعت وجود دارند(مثل سدیم، بریلیم و فلوئور). ولی اغلب عناصر بیش از یک ایزوتوپ دارند.مثلا قلع دارای ده ایزوتوپ است. اصطلاح نوکلید، به طور کلی، برای گونه های اتمی به کار می رود.
بسیاری از ایزوتوپها از ایزوتوپها رادیواکتیو هستن ، یعنی ذراتی با فرکانس بالا را از هسته (مرکز) اتمهای خود را ساطع می کنند . از آنها می توان برای دنبال کردن مسیر مواد متحرکی که از دید پنهان هستند ، مانند جریان خون در بدن یک بیمار در بیمارستان ، استفاده کرد.
جریان خون
مقدار کمی از یک ایزوتوپ رادیو اکتیو به درون جریان خون بیمار تزریق می شود . سپس مسیر آن توسط آشکارسازهای خاصی که فعالیت رادیواکتیویته را مشخص می کنند دنبال می شود . این اطلاعات به یک کامپیوتر داده می شود ، که صفحه آن هر گونه اختلالی ، مانند انعقاد خون در رگها ، را نشان می دهد . با استفاده از روشی مشابه ، می توان از ایزوتوپها برای مطالعه جریان مایعات در تاسیسات شیمیایی نیز استفاده کرد.
فرسودگی ماشین آلات
آهنگ فرسودگی ماشین آلات صنعتی را نیز می توان با استفاده از ایزوتوپها اندازه گرفت . مقادیر اندکی از ایزوتوپهای رادیواکتیو به بخشهای فلزی ماشین آلات ، مانند یاتاقانها و رینگ وپیستونها اضافه می شود . سپس سرعت فرسودگی با اندازه گرفتن رادیواکتیویته روغنی که برای روغنکاری این بخشها به کار رفته است مححاسبه می شود.
__________________
زمستان نیز رفت اما بهارانی نمی بینم
بر این تکرارِ در تکرار پایانی نمی بینم
به دنبال خودم چون گردبادی خسته می گردم
ولی از خویش جز گَردی به دامانی نمی بینم
چه بر ما رفته است ای عمر؟ ای یاقوت بی قیمت!
که غیر از مرگ، گردن بند ارزانی نمی بینم
زمین از دلبران خالی است یا من چشم ودل سیرم؟
که می گردم ولی زلف پریشانی نمی بینم
خدایا عشق درمانی به غیر از مرگ می خواهد
که من می میرم از این درد و درمانی نمی بینم
استاد فاضل نظری |

02-26-2010
|
 |
|
|
تاریخ عضویت: Aug 2009
نوشته ها: 16,247
سپاسها: : 9,677
9,666 سپاس در 4,139 نوشته ایشان در یکماه اخیر
|
|
 هالیدهای هیدروژن
هالیدهای هیدروژن
هالیدهای هیدروژن
هالیدهای هیدروژن ، ترکیباتی هستند مرکب از هیدروژن و هالوژنها. با این ترکیبات و روشهای تهیه این مواد آشنا میشویم.
واکنش مستقیم هالوژنها و هیدروژن
هر یک از هالیدهای هیدروژن را میتوان از واکنش مستقیم هیدروژن با هالوژن مربوط بدست آوردک
X2 + H2 -----> 2HX
شدت واکنش از فلوئور تا ید بهطور محسوسی کاهش مییابد. این واکنشها منابع صنعتی مهمی برای HI , HBr , HCl به شمار میآیند.
اثر اسید سولفوریک بر هالیدهای طبیعی
HCl , HF در صنعت ، از تاثیر سولفوریک اسید گرم و غلیظ بر هالیدهای طبیعی مربوطه ، CaF2 , NaCl تهیه میشوند.
CaF2 + H2SO4 -----> CaSO4 + 2HF
NaCl + H2SO4 -----> NaHSO4 + HCl
همه هالیدهای هیدروژن در دمای معمولی ، گازهای بیرنگند، در صورتی که اسید سولفوریک ، مایعی با نقطه جوش بالاست. بنابراین واکنشهای بالا ، نمونههایی از روش عمومی تهیه اسیدهای فرار از ترکیب نمکهای آنها و اسیدهای غیر فرار است. در دمای بالاتر (مثلا در 500 درجه سانتی گراد) ، NaCl و NaHSO4 نیز بر یکدیگر اثر میکنند.
NaCl + NaHSO4 -----> HCl + Na2SO4
عدم امکان تهیه HI و HBr با استفاده از این روش
هیدروژن برمید و هیدروژن یدید را نمیتوان از تاثیر اسید سولفوریک غلیظ بر برمیدها یا یدیدها بدست آورد، زیرا این آنیونها توسط اسیدسولفوریک گرم و غلیظ اکسید و به هالوژن آزاد تبدیل میشوند. یونهای برمید یدید آسانتر از آنیونهای فلوئورید و کلرید ، اکسید میشوند.
2NaBr + 2H2SO4 ----> Br2 + SO2 + Na2SO4 + H2O
چون قدرت کاهندگی یون یدید بیش از یون برمید است (آسانتر اکسید میشود)، لذا ، در واکنش NaI با اسید سولفوریک گرم و غلیظ ، H2S ، S و همچنین SO2 به عنوان محصولات عمل کاهش ، حاصل میشوند.
تاثیر اسید سولفوریک بر هالیدها
HI و HBr خالص را میتوان از تاثیر اسید فسفریک بر NaBr یا NaI بدست آورد. اسید فسفریک اساسا یک اسید غیر فرار و اکسنده ای ضعیف است:
NaBr + H3PO4 ----> HBr + NaH2PO4
NaI + H3PO4 ----> HI + NaH2PO4
هالیدهای هیدروژن را میتوان از اثر آب بر تریهالیدهای فسفر (PX3) بدست آورد.
PX3 + 3H2O ----> 3HX + H3PO3
تهیه HI و HBr به روش آزمایشگاهی
برای تهیه HI و HBr روش آزمایشگاهی آسانی توسعه یافته است. در این روش ، از تاثیر فسفر قرمز ، برم ، ید و مقدار محدودی آب بر یکدیگر استفاده شده و جدا کردن تریهالید فسفر حد واسط ضرورتی ندارد.
خواص فیزیکی هالیدهای هیدروژن
مولکولهای هیدروژن فلوئورید از طریق تشکیل پیوند هیدروژنی به هم میپیوندند. بخار این اسید در نزدیکی نقطه جوش آن (19,4 درجه سانتیگراد) شامل مجموعههایی تا 6(HF) است. ولی در دماهای بالاتر ، تعداد کمتری از مولکولها در این مجموعه شرکت میکنند. گازهای HI , HBr , HCl تکمولکولی هستند. تعداد پیوندهای هیدروژنی در HF مایع و جامد بیش از HF گازی است، به همین علت ، نقطه ذوب و نقطه جوش HF در مقایسه با نقطه ذوب و جوش سایر هالیدهای هیدروژن بهطور غیرعادی بالا است.
تمام هالیدهای هیدرژن به مقدار زیاد در آب حل میشوند. محلول این اسیدها در آب ، هیدروهالیک اسید نامیده میشود. مثلا محلول HI در آب ، هیدرویدیک اسید نام دارد. پیوند H-F قوی تر از هر پیوند H-X دیگر است. HF در محلول آبی اسید ضعیفی است ، حال آنکه HI , HBr , HCl کاملا تفکیک میشوند. به همین علت ، هیدروفلوئوریک اسید را نمیتوان در بطریهای شیشهای نگهداری کرد، بلکه این منظور باید از ظروف پلاستیکی یا مومی استفاده شود.
__________________
زمستان نیز رفت اما بهارانی نمی بینم
بر این تکرارِ در تکرار پایانی نمی بینم
به دنبال خودم چون گردبادی خسته می گردم
ولی از خویش جز گَردی به دامانی نمی بینم
چه بر ما رفته است ای عمر؟ ای یاقوت بی قیمت!
که غیر از مرگ، گردن بند ارزانی نمی بینم
زمین از دلبران خالی است یا من چشم ودل سیرم؟
که می گردم ولی زلف پریشانی نمی بینم
خدایا عشق درمانی به غیر از مرگ می خواهد
که من می میرم از این درد و درمانی نمی بینم
استاد فاضل نظری |

02-26-2010
|
 |
|
|
تاریخ عضویت: Aug 2009
نوشته ها: 16,247
سپاسها: : 9,677
9,666 سپاس در 4,139 نوشته ایشان در یکماه اخیر
|
|
 کاتالیزور
کاتالیزور
کاتالیزور
کاتالیزور ماده ای است که سرعت یک واکنش شیمیایی را افزایش می دهد بدون آنکه خود در جریان واکنش مصرف شود.
ریشه لغوی
کاتالیزور از دو صفت کاتا و لیزور تشکیل شده است. در زبان یونانی "کاتا" به معنای پائین ، افتادن ، یا پائین افتادن است و "لیزور" به معنی قطعه قطعه کردن میباشد. در برخی زبانها کاتالیزور را به معنی گردهم آوردن اجسام دور از هم معرفی کرده اند.
تاریخچه
اولین گزارش استفاده از کاتالیزور ، مربوط به کریشف میباشد که با استفاده از یک اسید به عنوان کاتالیزور توانست نشاسته را به قند ، هیدرولیزکند. بعدها دیوی توانست واکنش اکسیداسیون هیدروژن را با اکسیژن در حضور کاتالیزورپلاتین انجام دهد که این واکنش یک واکنش گرما گیر است و در نتیجه هنگام انجام واکنش جرقه تولید میشد.
اولین کار در توضیح اینکه چرا یک واکنش کاتالیزوری انجام میگیرد و کاتالیزور چه نقشی دارد، توسط "فارادی" انجام شد. بیشترین بهرهبرداری از کاتالیزور در جنگ جهانی بود.
انقلاب تکنولوژی اصلی در زمینه کاتالیزور مربوط به نیمه دوم قرن 20 یعنی بین سالهای1980 ـ 1950 میباشد.دهه 1960 ـ 1950 دهه ای است که با تولید کاتالیزورهای زیگر _ ناتا ترکیبات بسیار مهم و استراتژیک ساخته شد.
انواع کاتالیزور
کاتالیزور به دو نوع کاتالیزور مرغوب و نامرغوب تقسیم میشود:
کاتالیزور مرغوب: کاتالیزور مرغوب به کاتالیزوری گفته میشود که فقط اجازه تشکیل یک نوع محصول را بدهد.
کاتالیزور نامرغوب: اگر در حضور کاتالیزور محصولات متفاوتی امکان تشکیل داشته باشند کاتالیزور نامرغوب تلقی میشود.
چگونگی عمل کاتالیزور
تجربه نشان داده است که واکنش با کاتالیزور در دمای کمتری صورت میگیرد و همچنین کاتالیزور ، انرژی اکتیواسیون را پائین میآورد یا کاهش میدهد یا باعث میشود مولکولهای درشت به مولکولهای کوچکتر ، قطعهقطعه یا شکسته شوند.
کاتالیزور واکنش را میتوان بدون تغییر در پایان واکنش بدست آورد. مثلا سرعت تجزیه KClO3 را با مقدار کمی MNO2 میتوان فوقالعاده زیاد کرد. در معادلهای که برای این تغییر نوشته میشود ، کاتالیزور را بالای پیکان میگذارند ، زیرا کاربرد آن در استوکیومتری کل واکنش اثری ندارد:
KClO3--------->2KCl+3O2
مکانیسم واکنش کاتالیزوردار
کاتالیزور نمیتواند موجب وقوع واکنشهایی شود که از نظر ترمودینامیک امکان وقوع ندارند. بعلاوه صرفا حضور کاتالیزور نیست که (احتمالا بعنوان یک بخش فعالکننده) موجب اثر بر سرعت واکنش میشود. در یک واکنش کاتالیزوردار ، کاتالیزور در یک مرحله عملا مصرف میشود و در مرحله بعدی بار دیگر تولید میگردد و این عمل بارها تکرار میگردد، بدون آنکه کاتالیزور دچار تغییر دائمی شود.
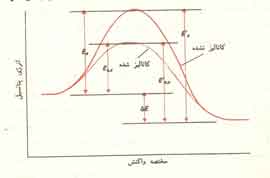
بنابراین کار کاتالیزور آن است که راه تازه ای برای پیشرفت واکنش میگشاید. بدین ترتیب مکانیسم کاتالیزوردار با یک واکنش بیکاتالیزور تفاوت دارد. انرژی فعال سازی راهی که واکنش به کمک کاتالیزور طی میکند، کمتر از انرژی فعالسازی راهی است که همان واکنش بدون کاتالیزور میپیماید (شکل 1)
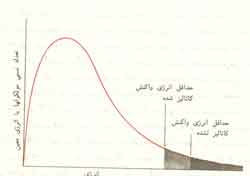
این واقعیتی است که علت سریعتر شدن واکنش را توجیه میکند. وقتی کاتالیزور بکار برده میشود، مولکولهای نسبتا بیشتری انرژی لازم برای یک برخورد موفق پیدا میکنند (شکل 2). بدین ترتیب عده کل برخوردهای موثر در واحد زمان، که موجب انجام واکنش میشوند، افزایش مییابد.
در شکل 1 به دو نکته دیگر نیز پی میبریم. نخست آنکه تغییرات انرژی برای واکنش کاتالیزوردار و واکنش بیکاتالیزور یکسان است. دیگر آنکه انرژی فعال سازی واکنش معکوس نیز به هنگام استفاده از کاتالیزور کاهش مییابد و مقدار کاهش آن درست برابر کم شدن انرژی فعال سازی واکنش کاتالیزوردار اصلی است. این بدان معنی است که کاتالیزور بر یک واکنشی و واکنش معکوس آن اثر یکسان دارد. اگر یک کاتالیزور سرعت یک واکنش را دو برابر کند، همان کاتالیزور سرعت واکنش معکوس آن را نیز دو برابر خواهد کرد.
کاتالیزورهای طبیعی (آنزیم)
بسیاری از فرایندهای صنعتی به اعمالی بستگی دارند که با کاتالیزور صورت میگیرند. ولی کاتالیزورهایی که برای انسان مورد اهمیت بیشتری دارند، کاتالیزورهای طبیعی یعنی آنزیمها هستند. این مواد فوق العاده پیچیده ، فرایندهای حیاتی مانند گوارش و سنتز سلولی را کاتالیز میکنند.
عده زیادی از واکنشهای شیمیایی پیچیده که در بدن صورت میگیرد و برای حیات ما ضرورت دارد، به علت اثر آنزیمها در دمای پائین بدن امکان وقوع پیدا میکنند. هزاران آنزیم وجود دارند که هر یک وظیفه خاصی را انجام میدهند. تحقیق درباره ساختمان و عمل آنزیمها ، نویدهای فراوانی درباره پیشرفت شناخت عامل بیماری و مکانیسم رشد میدهد.
کاتالیزور همگن و ناهمگن
در کاتالیزور همگنماده ای که بعنوان کاتالیزور کار میکند، با مواد واکنشدهنده در یک فازند، ولی در یک کاتالیزور ناهمگن یا کاتالیزور سطحی ، مواد واکنشدهنده و کاتالیزور در دو فاز مجزا کنار هم هستند و واکنش در سطح کاتالیزور صورت میگیرد.
کاتالیزور همگن
نمونه ای از کاتالیزور همگن در فاز گازی ، اثر کلر در تجزیه دینیترون اکسید است. گاز دینیترون اکسید ، در دمای اتاق ، گاز نسبتا بیاثری است، اما در دماهای نزدیک به صد درجه طبق معادله زیر تجزیه می شود.
(2N2O(g)--------->2N2(g)+O2(g
مطالعات سینتیک نشان میدهد که واکنش مذکور بر اثر برخورد بین دو ملکول کلر کاتالیز میشود.
کاتالیزور همگن در محلول نیز ممکن است صورت گیرد. بسیاری از واکنشها بوسیله اسیدها و بازها کاتالیز میشوند. تجزیه هیدروژن پراکسید در حضور پون یدید کاتالیز میشود.
کاتالیزور ناهمگن
کاتالیزور ناهمگن عمدتا از طریق جذب سطحی شیمیایی مواد واکنش دهنده بر سطح کاتالیزور صورت میگیرد. جذب سطحی فرآیندی است که در جریان آن مولکولها به سطح جسمی جامد میچسبند. مثلا در ماسکهای گازی ، زغال به عنوان یک ماده جاذب برای گازهای زیان آور بکار میرود.
در جذب سطحی فیزیکی معمولی ، مولکولها ، بوسیله نیروهای و اندروالسی به سطح ماده جاذب ، گیر میکنند. بنابراین مولکولهایی از گاز که جذب سطحی شدهاند، تا همان حد تحت تاثیر قرار گرفتهاند که گویی مایع شده باشند.
در جذب سطحی شیمیایی ، مولکولهای جذب شده ، با پیوندهایی که قابل مقایسه با پیوندهای شیمیایی است، به سطح ماده کاتالیزور نگه داشته میشوند. در فرایند تشکیل پیوند با ماده جاذب ، مولکولهایی که بطور شیمیایی جذب شدهاند، دچار تغییر آرایش الکترونی درونی میشوند. پیوندهای درون بعضی از مولکولهای کشیده و ضعیف و حتی پیوند بعضی از آنها شکسته میشوند.
مثلا هیدروژن بصورت اتمی بر سطح پلاتین جذب میشود. بنابراین تعدادی از ملکولها که بطور شیمیایی جذب سطحی شدهاند، به صورت کمپلکس فعال شده یک واکنشی که در سطح کاتالیزور شده، عمل میکند.
مکانیسم جذب سطحی شیمیایی:
تاکنون مکانیسم دقیق جذب سطحی شیمیایی و کاتالیز سطح کاملا فهمیده نشده است، فقط فرضهایی قابل قبول برای مکانیسم چند واکنش خاصی مطرح شده است:
نظری دال بر اینکه نقصها یا بینظمیهای شبکه در سطح کاتالیزور ، جای فعالی برای عمل کاتالیزور است، اولین فرضیه برای توضیح عمل تقویت کنندههای کاتالیزورهای مناسب است. تقویت کننده ها موادی هستند که فعالیت کاتالیزور ها را زیاد میکنند. مثلا در سنتز آمونیاک
(N2(g)+3H2(g)----------->2NH3(g
اگر کاتالیزورآهن با مقدار کمی پتاسیم یا وانادیم آمیخته شده باشد، بیشتر موثر واقع میشود.
سموم کاتالیزور
سموم کاتالیزور موادی هستند که کاتالیزورها را از فعالیت باز میدارند. مثلا مقدار کمی آرسنیک توانایی پلاتین را که کاتالیزور تبدیل سولفور دیاکسید ،به سولفور تریاکسید است، از بین میبرد.
(2SO2(g)----------->2SO2(g
احتمالا در این عمل بر سطح پلاتین ، پلاتینم ارسیند تشکیل میشود و فعالیت کاتالیزوری از میان میرود. جذب اتیلن ، کاتالیزور را موقتا مسموم میکند، درحالیکه جذب پلاتین ، کاتالیزور را بطور دائم مسموم میکند.
اختصاصی بودن فعالیت کاتالیزور
فعالیت کاتالیزورها عمدتا بسیار اختصاصی است. در پارهای موارد ، کاتالیزور معین موجب سنتز نوعی محصولات خاص از بعضی مواد میشود، حال آنکه کاتالیزور دیگر موجب سنتز محصولات کاملا متفاوت دیگری از همان مواد میشود. البته در این موارد امکان وقوع هر دو واکنش از لحاظ ترمودینامیکی میسر است. مثلاکربن مونوکسید و هیدروژن بر هم اثر میکنند و بسته به شرایط واکنش و نوع کاتالیزور مصرف شده ، محصولات بسیار متنوعی ایجاد میکنند.
اگر کبالت یا نیکل بعنوان کاتالیزور بکاربرده شود، مخلوطی از هیدروکربنها بوجود میآورد. در این جا نیکل بعنوان یک کاتالیزور نامرغوب عمل میکند.
CO(g)+3H2(g)------------>CH4(g)+H2O
و اگر مخلوطی از روی و اکسید کرم بعنوان کاتالیزور مصرف شود، از واکنش متانول تولید میشود.
(CO(g)+2H2(g)------------>CH3OH(g
برای این واکنش ، نیکل یک کاتالیزور مرغوب است.کاتالیزور مرغوب کاتالیزوری است که انتخابی عمل کند.
غیر فعال شدن کاتالیزور
معمولا تمام کاتالیزورها دارای یک عمر معین هستند که پس از سپری شدن آن فعالیت موثر آنها کاهش مییابد که ممکن است بطور ناگهانی یا تدریجی باشد (افت فعالیت). در چنین مواقعی معمولا بسته به نوع و مکانیسم غیر فعال شدن ، باید کاتالیروز را بازیابی یا جایگزین کرد. در این مواقع باید تصمیم بگیریم که آن را تعویض یا احیا کنیم. تصمیم بر اساس مکانیسم های غیر فعال شدن است و مهمترین و متداولترین مکانیسم غیر فعال شدن عبارت است از:
در کاتالیزورهای نفتی ، تجزیه هیدروکربنها در دمای بالا موجب تشکیل لایه ضخیمی از کربن غیر فعال روی سطوح کاتالیزور میگردد که همین دوره باعث میشود که روی سایت کاتالیزور پوشیده و از کار میافتد.
پدیده دوم مربوط به مسموم شدن کاتالیزور میباشد. این پدیده زمانی اتفاق میافتد که ماده جذب شونده باعث تعییر آرایش کاتالیزور میشود. آرایش بلوری در فعالیت کاتالیزور نقش اساسی دارد. تغییر آرایش بلوری باعث غیر فعال شدن آن میشود. عواملی مانند سولفور این پدیده را ایجاد میکند.
عامل سوم مربوط به وجود ناخالصیهای فلزی در سطح کاتالیزور میباشد. این ناخالصیها در مناطق فعال ، جذب و فعالیت کاتالیزور را کاهش میدهند.
اورگانومتالیکهای فلزی معمولا به مقدار بسیار به عنوان کاتالیستها مورد استفاده قرار میگیرند. از تجزیه ناخواسته این کاتالیستها در دمای بالا اورگانومتالیکهای تیتانیم و وانادیم ایجاد شده، ضمن بلوکه کردن کانالهای کاتالیکی باعث کاهش فعالیت کاتالیزوری میشوند.
معمولا ساختمان کاتالیزورها یک ساختمان متخلخل و پرزدار است. حفره های میکرونی در روی کاتالیزور وجود دارد که شوکهای حرارتی باعث مسدود شدن این میکرو پرزها میگردد. بنابراین شوکهای حراراتی ممکن است فعالیت کاتالیزورها را کاهش دهد.
بازیابی کاتالیزور
کاتالیزور را میتوان با عبور هوای گرم احیا کرد.
در مکانیسم های دیگر از وجود ناخالصیها که باعث مسموم شدن کاتالیزور می شود جلوگیری کرد.
طبقه بندی سیستم های کاتالیکی
عملکرد کاتالیزورها در دو فار هموژن و هتروژن انجام میگردد. فاز هموژن حالتی است که مواد واکنشدهنده و کاتالیزور در یک فاز قرار میگیرند. حال آنکه اگر عملکرد کاتالیزور و مواد واکنشدهنده در دو فاز مختلف باشد و مرز فیزیکی بین کاتالیزور و مواد واکنشدهنده وجود داشته باشد، چنین فازی را هتروژن میگویند.
کاتالیزورهای جامد
جامد فلزی:
مناسب واکنشهایی هستند که مواد واکنشی از هیدروژن و یا هیدرو کربن تشکیل شدهاند. عمده کاتالیزورهای این دسته از عناصر واسطه تشکیل میگردد. مثل نقره ، پلاتین ، آهن و نیکل و پالادیم.
معمولا ویژگی این فلزات و کاتالیزورها به گونه ای است که هم هیدروژن و هم هیدروکربن به راحتی در سطح این کاتالیزورها جذب میگردند. این کاتالیزورها برای واکنشهای هیدروژن و هیدروژنگیری مناسب است و برای واکنشهای اکسیداسیون مناسب نیست، چون احتمال اکسید شدن خود فلزات هم وجود دارد.
کاتالیزورهای اکسید فلزی:
اکسید روی ، اکسید نیکل ، اکسید منگنز ، اکسید کروم ، اکسید بیسموت ، اکسید مولیبدن. ویژگی این کاتالیزورها در این است که میتوانند در واکنش ، اکسیژن مبادله کنند (یعنی میتوانند اکسیژن را دوباره به حالت اول برگردانند).
کاتالیزروهای اکسید فلزی _ عایق:
اکسید منیزیم ، اکسید آلومینیم ، سیلیس. این کاتالیزورها بعنوان جاذبه الرطوبه مورد استفاده قرار میگیرند.
کاتالیزورهای زیگلر _ ناتا:
در پلیمریزاسیون استفاده میشود. نسل جدیدی از کاتالیزورهای زیگلر _ ناتا در متالوسیون استفاده میشود.
عوامل موثر در فعالیت کاتالیزور
سطح کاتالیزور
قدرت و استحکام پیوند جذبی
راههای افزایش سطح کاتالیزور
پودر کردن یعنی افزایش سطح کاتالیزور بطریق فیزیکی
ایجاد خلل و فرج و کانالهای بسیار ظریف میکروسکوپی در بدنه کاتالیزور
نشاندن کاتالیزور روی بستری از آلومینا و زئولیت
متخلخل کردن کاتالیزور
کاربرد کاتالیزور
کاتالیزور در سه بخش به کار می رود:
1.صنعت اتومبیل:
در این بخش کاتالیزورها بصورت مستقیم و غیرمستقیم استفاده میشوند. در اگزوز اتومبیلها بستری از فلزات جامد مثل پلاتین روی پایه آلومینات قرار گرفته و هیدروکربنهای مضر مثل منوکسید کربن و غیره را جذب میکند.
2.صنعت نفت و پالایش مواد نفتی:
عمده ترین مصرف کاتالیزورها در صنعت نفت در دو پروسه کراکینگ (شکستن مولکولهای درشت به کوچک) و رفرمینگ (دوباره باز آرائی و ترکیب مولکولهایی برای تولید) میباشد.
در صنعت نفت بیشتر کاتالیزورهای زیگلر _ ناتا، کاتالیزورهای فلزی و اورگانومتالیک مثل رودیوم استفاده میشود.
3.تولید مواد شیمیایی
__________________
زمستان نیز رفت اما بهارانی نمی بینم
بر این تکرارِ در تکرار پایانی نمی بینم
به دنبال خودم چون گردبادی خسته می گردم
ولی از خویش جز گَردی به دامانی نمی بینم
چه بر ما رفته است ای عمر؟ ای یاقوت بی قیمت!
که غیر از مرگ، گردن بند ارزانی نمی بینم
زمین از دلبران خالی است یا من چشم ودل سیرم؟
که می گردم ولی زلف پریشانی نمی بینم
خدایا عشق درمانی به غیر از مرگ می خواهد
که من می میرم از این درد و درمانی نمی بینم
استاد فاضل نظری |
|
کاربران در حال دیدن موضوع: 1 نفر (0 عضو و 1 مهمان)
|
|
|
 مجوز های ارسال و ویرایش
مجوز های ارسال و ویرایش
|
شما نمیتوانید موضوع جدیدی ارسال کنید
شما امکان ارسال پاسخ را ندارید
شما نمیتوانید فایل پیوست در پست خود ضمیمه کنید
شما نمیتوانید پست های خود را ویرایش کنید
اچ تی ام ال غیر فعال می باشد
|
|
|
اکنون ساعت 06:42 AM برپایه ساعت جهانی (GMT - گرینویچ) +3.5 می باشد.
|









 حالت خطی
حالت خطی

