
|
|
|||||||
| شیمی در این تالار مباحث و مطالب مرتبط با علم شیمی گذارده خواهد شد |
 |
|
|
ابزارهای موضوع | نحوه نمایش |
|
#1
|
||||
|
||||
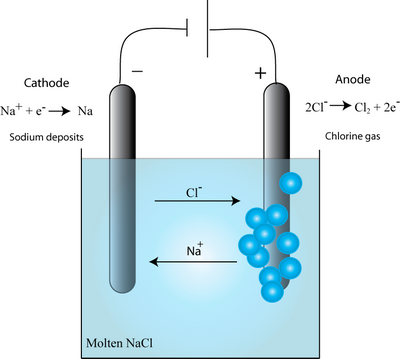
 رسانش الکترولیتی والکترولیز
رسانش الکترولیتی والکترولیز
رسانش الکترولیتی
__________________
|
| کاربران زیر از ROJINAjoON به خاطر پست مفیدش تشکر کرده اند : | ||
| جای تبلیغات شما اینجا خالیست با ما تماس بگیرید | |
|
|
|
 |
| کاربران در حال دیدن موضوع: 1 نفر (0 عضو و 1 مهمان) | |
|
|
اکنون ساعت 08:22 PM برپایه ساعت جهانی (GMT - گرینویچ) +3.5 می باشد.





 حالت خطی
حالت خطی

